Information
发布时间:2023-05-12

自新冠疫情以来,mRNA疫苗在战胜疫情中扮演了至关重要的角色,成为公众关注的焦点,技术平台快速发展。但是由于mRNA技术的应用相对较新,仍需要监管指南和行业标准来规范和指导整个行业的技术发展、质量提升。2022年2月,USP发布了《mRNA疫苗质量第一版指南草案》,其关于mRNA DS详实明确的质量管理和分析方案为整个行业提供了巨大的技术支持。
mRNA技术快速发展,其疫苗和药物在传染性疾病和肿瘤等多个领域中展现了越来越高的潜力,时隔一年,USP在2023年4月发布了《mRNA疫苗质量分析方法-指南草案》(第二版)。与第一版只聚焦于mRNA DS不同,经过一年的沉淀,第二版的指南草案从整个mRNA疫苗产品的全生命周期出发,基于QbD的理念,内容扩展到了三大部分的表征和放行测试,包括质粒DNA(Proposed testing for plasmid DNA prior to release)、mRNA药物原料(Characterization and release testing for mRNA Drug Substance)和mRNA药物制剂(Characterization and release testing for mRNA Drug Product)。第二版新增了质粒DNA的表征和放行测试,详情见下表。
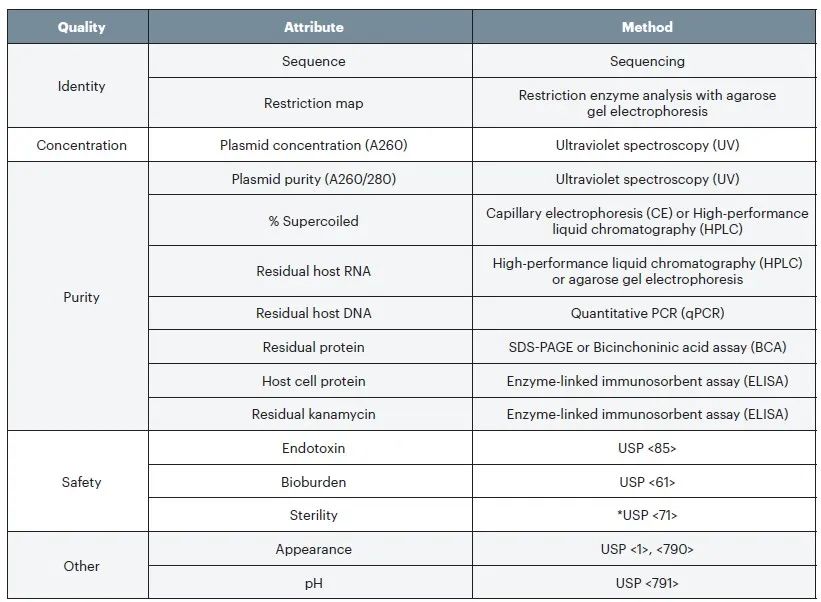
Table 1 Proposed testing for plasmid DNA prior to release
mRNA药物原料的表征和放行测试是mRNA重要的质量管理部分,主要包括mRNA浓度及纯度、mRNA序列完整性、表达能力及安全性等方面。囿于篇幅,我们主要和大家介绍一下mRNA药物原料表征和放行测试新版内容和两版差异内容,具体详情如下表所示。
Table 2 Comparison of New and Old Drafts on Characterization and release testing for mRNA Drug Substance
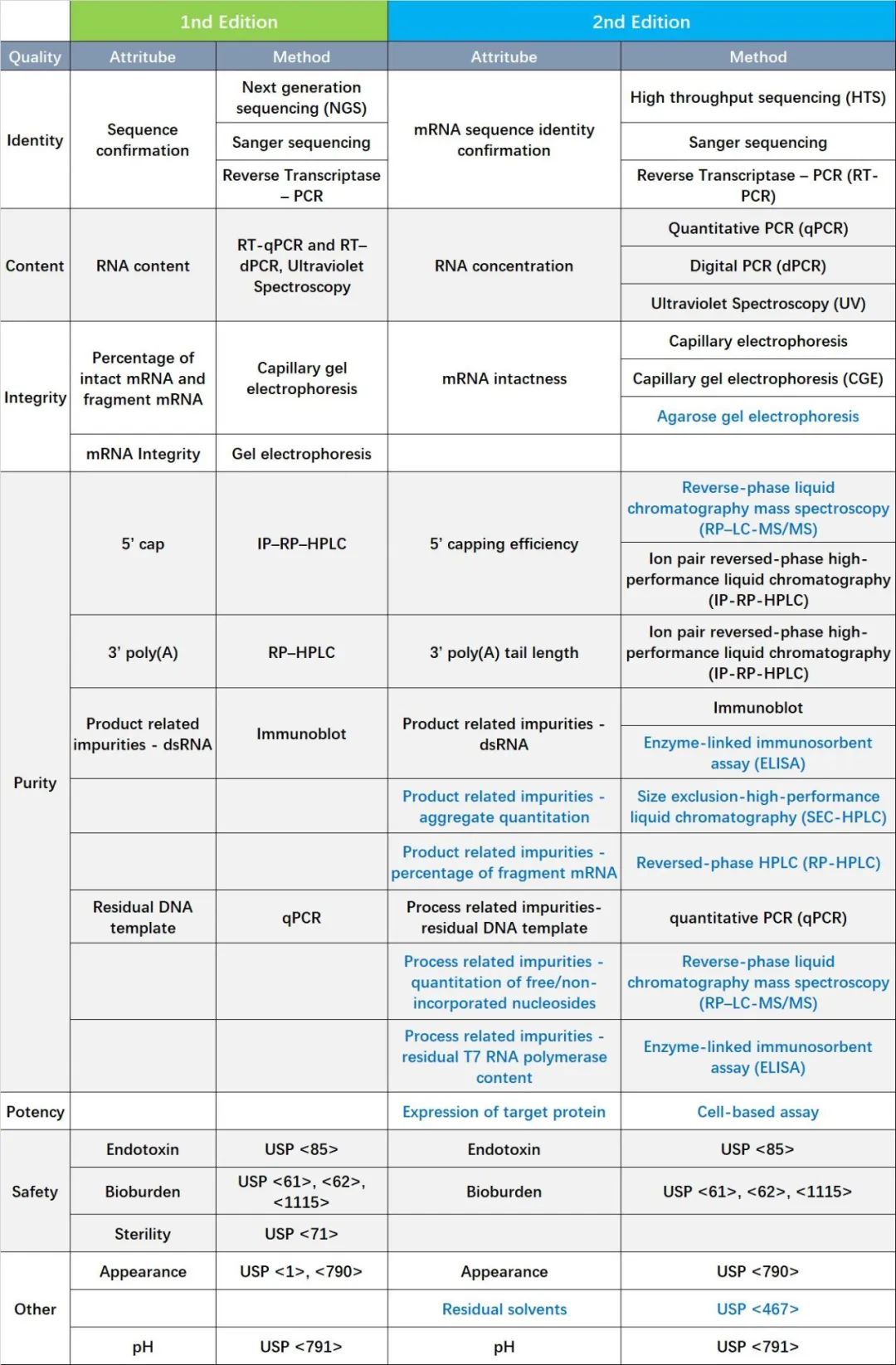
与第一版相比,第二版在这原液部分主要更新了以下7方面的内容:
1)在完整性方面,新增了AGE的方法;
2)在加帽效率方面,增加了RP–LC-MS/MS的方法;
3)dsRNA的检测方面,增加了ELISA的方法;
4)新增了残留核苷酸和T7 RNA聚合酶的检测方法;
5)新增了评价目的蛋白表达的效力研究;
6)新增了残留溶剂的检测;
7)新增了聚体定量方法和mRMA不完整片段的分析方法。
另外,很多相同的方法检测细节也经过了更新完善,在此不一一赘述。
作者|曹成浩
编辑|范玉美
排版|林怡馨
审稿|李军辉
免责声明:
文章内容仅供参考,旨在知识共享,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证,所有内容仅学术交流研究,不构成任何建议,如有信息疏漏或者侵权,请联系 yumeifan@cojourney.com,不胜感谢。